Comment est née cette méthode antidouleur reposant sur la lumière ?
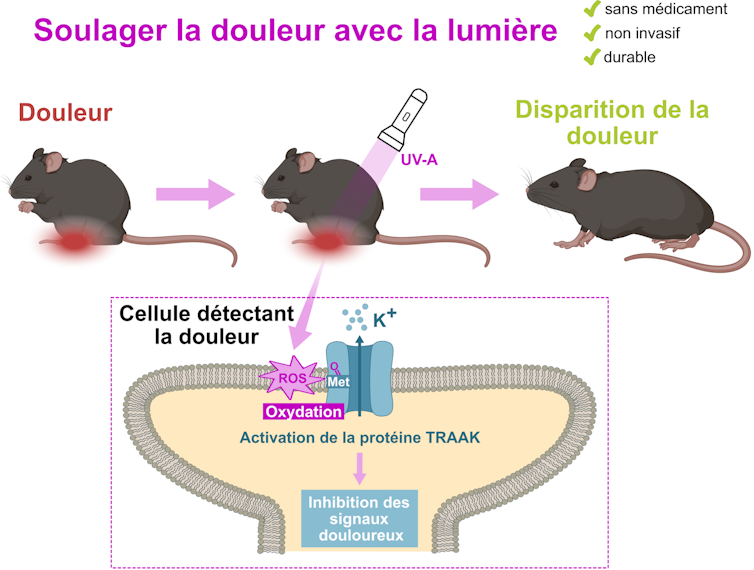
Comme Pasteur l’a dit, « le hasard ne favorise que les esprits préparés ». Effectivement, toute notre étude repose sur une observation inattendue que nous avons faite lors d’une expérience témoin : une protéine appelée TRAAK s’active (en d’autres mots, elle se met en marche), lorsqu’elle est éclairée avec de la lumière UV-A.
Aussi fortuite qu’elle puisse paraître, cette observation nous a souri puisque l’activité principale de notre laboratoire porte sur TRAAK et les protéines qui lui sont proches.
TRAAK est une protéine présente dans les récepteurs de la douleur et freine la transmission des messages douloureux vers le cerveau quand elle est dans son état actif. D’où notre idée : activer ces protéines des récepteurs de la douleur présents dans la peau avec de la lumière et ainsi inhiber les récepteurs de la douleur. Cela empêcherait alors les messages nerveux d’atteindre le cerveau, résultant en de l’analgésie.
Pour vérifier cela, nous avons illuminé les pattes de souris et avons testé leur sensibilité mécanique en déterminant la pression à appliquer pour déclencher leur réflexe de retrait de la patte. Cette procédure, couramment utilisée en expérimentation animale et humaine n’induit aucune douleur chez la souris puisque le réflexe est déclenché physiologiquement avant que la souris ne ressente la douleur. Nous avons ainsi pu montrer que, après le traitement à la lumière, il faut trois fois plus de force pour induire le retrait, ce qui veut dire que les pattes des souris deviennent trois fois moins sensibles, que ce soit sur des souris saines ou soumises à une douleur chronique pour une durée allant jusqu’à six heures. Nous avons même démontré que cet effet est plus efficace et durable que les antidouleurs utilisés couramment, comme l’ibuprofène ou la crème anesthésiante Emla (souvent utilisée lors de la vaccination).
Pourquoi cette découverte est-elle importante ?
Ce nouveau traitement est non invasif, peu coûteux et simple à mettre en place. De plus, l’analgésie induite par la lumière (LIA) ne requiert aucune injection ni traitement médicamenteux et permet de s’affranchir de tout effet secondaire ou d’interaction médicamenteuse. Ce dernier point en fait une véritable aubaine en expérimentation animale, en proposant une solution pour soulager la douleur sans avoir de répercussion sur les conclusions des expériences.
En effet, dans le cadre des expériences précliniques sur rongeurs, bien contrôler la douleur est essentiel, à la fois pour le bien-être des animaux et pour la fiabilité des résultats scientifiques. Une douleur mal prise en charge peut en effet modifier le fonctionnement de l’organisme et fausser les observations et conclusions de l’étude. Les solutions actuelles pour soulager la douleur reposent essentiellement sur des médicaments qui sont efficaces mais susceptibles d’induire des effets secondaires pouvant modifier les paramètres biologiques étudiés et ainsi fausser les résultats et conclusions de l’étude.
Au-delà du cadre de l’expérimentation animale, la LIA pourra être appliquée aux nouveaux animaux de compagnie pour une analgésie locale, rapide et robuste. Par exemple, un vétérinaire pourrait l’employer pour rendre plus supportable le nettoyage d’un abcès chez les hamsters.
Quelles sont les suites de cette étude ?
La LIA n’est pas applicable chez l’humain, une unique différence dans la séquence de TRAAK rend la lumière inefficace sur la version humaine de la protéine : la lumière n’aura donc aucun effet antidouleur.
Nous sommes tout de même très excités, car notre étude identifie TRAAK comme une cible prometteuse pour le développement de nouveaux traitements antidouleur, y compris chez l’humain (en l’activant d’une manière différente). Nous allons donc poursuivre nos travaux pour développer des molécules activant TRAAK et proposer une stratégie potentiellement plus efficace et plus ciblée que les antidouleurs disponibles actuellement sur le marché.
Enfin, même si nous avons déterminé le mécanisme moléculaire à l’origine de l’activation de TRAAK par la lumière, une question subsiste : pourquoi certaines espèces possèdent-elles une version activable à la lumière ? Cela joue-t-il un rôle physiologique, par exemple au niveau du rythme nocturne/diurne des espèces ou encore dans la vision ? Nous comptons bien trouver des explications en étudiant quelles espèces possèdent une protéine TRAAK sensible à la lumière et leurs caractéristiques écologiques.
Tout savoir en trois minutes sur des résultats récents de recherches commentés et contextualisés par les chercheuses et les chercheurs qui les ont menées, c’est le principe de nos « Research Briefs ». Un format à retrouver ici.![]()
Marion Bied, Docteure en biologie et Guillaume Sandoz, Directeur de Recherche, tous deux chercheurs à l'IBV (Université Côte d’Azur, CNRS, Inserm)
Cet article est republié à partir de The Conversation sous licence Creative Commons. Lire l’article original.
THE CONVERSATION
Université Côte d’Azur, par son service Science et Société, a adhéré depuis janvier 2022 au média d’actualité en ligne « The conversation ». L’objectif est de mettre en valeur les travaux de nos équipes de recherche au service d’une information éclairée et fiable qui participe au débat citoyen.
The Conversation est un média en ligne et une association à but non lucratif. Son modèle de collaboration entre experts et journalistes est unique : partager le savoir, en faisant entendre la voix des chercheuses et chercheurs dans le débat citoyen, éclairer l'actualité par de l'expertise fiable, fondée sur des recherches.
theconversation.com
ABONNEZ-VOUS !
Pour suivre au quotidien les experts de The Conversation, abonnez-vous à la newsletter.
theconversation.com/fr/new




